・下垂体前葉のSomatotrph cellから分泌される
・Somatotrph cellは下垂体前葉の45%を占めており, 健常成人における下垂体内には15mgのGHが蓄えられている
・高齢になるに伴い, GHの量は低下.
・GHは視床下部より分泌されるGH−RHにより下垂体前葉より分泌される
・GHは拍動性に分泌され, 1日に分泌されるGHの65%が夜間に分泌されている. 睡眠が分泌の誘発因子となる
・拍動性にGHが分泌されたあとはトラフとなり, トラフでは血中濃度は検出感度以下.
従って, GH欠乏や過剰を調べるのにGHの血中濃度は意味がない
・また, 肥満ではGHは多く分泌され, 低栄養ではGH分泌は抑制される.
(J Clin Endocrinol Metab 98: 2187–2197, 2013)
成人におけるGH欠乏症
小児におけるGH欠乏では小人症や発達障害を生じるが成人例のGH欠乏症では非特異的症状を呈する.
体組織の脂肪の増加, 体重減少, 抑うつ症状, 無気力感など.
BMDの低下にも関連する.
成人におけるGH欠乏症の原因(J Clin Endocrinol Metab 98: 2187–2197, 2013)
原因
|
|||
外傷性
|
脳外科手術
頭部放射線療法 外傷性脳挫傷 |
腫瘍性
|
下垂体腺腫
下垂体周囲腫瘍 (ラトケ嚢胞, 髄膜腫, Geminoma, Ependymoma, Glioma)
Craniopharyngioma, 視床下部腫瘍, 下垂体転移, 血液腫瘍
|
浸潤/炎症性
|
原発性下垂体炎
サルコイド, Histiocytosis X, GPA, ヘモクロマトーシス |
||
感染症
|
結核, カリニ,
真菌感染, 寄生虫 ウイルス感染 |
||
血管
|
妊娠関連
動脈瘤, SHA, 血管炎 |
その他
|
副甲状腺機能亢進症
ソマトスタチンアナログの使用 特発性 |
13例の脳挫傷患者のうち2.5M−11年のフォローで5例がGH欠乏 (Hormones and Behavior 63 (2013) 331–344 )
放射線療法後の下垂体機能の評価では, 治療後最も早期に欠乏するのがGH. 4年程度で欠乏する.(J Clin Endocrinol Metab 98: 2187–2197, 2013)
放射線療法後では視床下部機能不全が生じ, その後10年以上経過して下垂体機能も低下.(J Clin Endocrinol Metab 88: 95–102, 2003)
外傷に伴う下垂体不全, 欠乏ホルモンの頻度(Lancet 2007;369:1461-70)
N
|
Any degree of hypopituitarism
|
汎機能低下
|
GH
|
LH/FSH
|
ACTH
|
TSH
|
749
|
35%
|
9%
|
11%
|
13%
|
11%
|
6%
|
N
|
Any degree of hypopituitarism
|
汎機能低下
|
GH
|
LH/FSH
|
ACTH
|
TSH
|
122
|
48%
|
9%
|
26%
|
11%
|
16%
|
5%
|
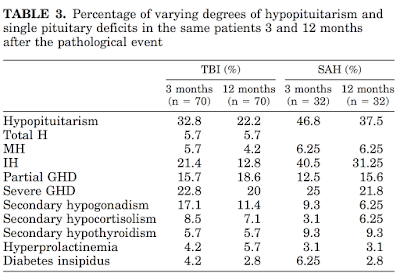
脳挫傷後3ヶ月では8.5%、12ヶ月では7.1%で二次性副腎不全
一方SAHでは3ヶ月後3.1%、12ヶ月後6.25%と増加する.
一方SAHでは3ヶ月後3.1%、12ヶ月後6.25%と増加する.
(J Clin Endocrinol Metab 90: 6085– 6092, 2005)
・頭部外傷や脳卒中の既往がある患者で倦怠感やQOLの低下、筋組織の萎縮、脂肪の増加など、不定愁訴が認められる場合はGH欠乏も考慮する.
ちなみに, 先天性のGH欠乏の原因 (J Clin Endocrinol Metab, June 2011, 96(6):1587–1609 )
GH欠乏症の診断
負荷試験
成人におけるGH欠乏症の診断は, インスリン負荷試験(ITT)とGH-RH + アルギニン負荷試験.
インスリン負荷試験がGold standardとされている。(J Clin Endocrinol Metab, June 2011, 96(6):1587–1609 )
・低血糖は視床下部, 下垂体でのGH−RH, GH産生を刺激
アルギニンは視床下部を刺激し、GH−RHは下垂体を刺激することでGH産生を促す.
・他にグルカゴン刺激試験があるが, これは上記2つの検査が施行困難な場合に選択する.
グルカゴンもGH分泌を促す因子であるが, 機序が不明な点, 反応まで3時間以上フォローせねばならない点から第一選択とはならない.
・ITTは痙攣既往, 心血管リスクがある患者では避ける.
・GH-RH+アルギニン負荷試験は視床下部機能低下によるGH欠乏症での感度は低下する.
・GH欠乏症のリスクがある場合は上記試験で診断可能であるが, 特にリスクがない場合(=特発性GH欠乏症を疑う場合)は上記刺激試験を2種類以上行う.
特発性GH欠乏は稀なため, 偽陽性のリスクを減らすため.
刺激試験2種類ではなく, IGF−1低値を証明するのも一つの手.
他の下垂体ホルモンの分泌低下があればより疑いは濃厚となる.
負荷試験の方法
全患者で夜間, 負荷試験前10時間絶食とし, 検査中は安静とする
点滴ルートは基礎値評価の30−60分前に留置.
血液検査は30分毎に基礎, 負荷後 30, 60, 90, 120, 150分に採取
・ITT: インスリン 0.10−0.15U/kgを投与し, 血糖を<40mg/dLとし, その際のGH値を評価する.
痙攣既往がある患者, 心血管リスク因子がある患者では避ける.
・アルギニン試験: L-アルギニン 30gを30分かけてIVする
・L-DOPA試験: L−DOPA 500mgを経口より投与
・アルギニン-L−DOPA試験: 上記2つを同時に施行.
・GHRH-アルギニン試験: GHRH 1µg/kgを経静脈投与し, アルギニン試験を同時に行う.
各負荷試験の感度, 特異度
試験
|
カットオフ
|
感度
|
特異度
|
インスリン負荷
|
5.1µg/L
|
96%
|
92%
|
GHRH−アルギニン
|
4.1µg/L
|
95%
|
91%
|
アルギニン-L−DOPA
|
1.7µg/L
|
97%
|
79%
|
アルギニン
|
0.4µg/L
|
87%
|
91%
|
L−DOPA
|
1.1µg/L
|
100%
|
62%
|
IGF−1
|
127.1µg/L
|
85%
|
68%
|
IGF−1 SDS
|
-2.00
|
46%
|
100%
|
下垂体不全患者(複数のホルモン分泌障害例) 39例と年齢, 性別, エストロゲン治療の有無, BMIを合わせたコントロール群34例, 成人発症の視床下部−下垂体疾患で, ホルモン分泌障害が0−1種類のみの群21例において, 各種刺激試験を施行したデータより.
平均年齢は約50歳 (J Clin Endocrinol Metab 87: 2067–2079, 2002)
IGF−1については後述. SDSは標準偏差をスコア化したもの.
ちなみに患者の好みで最も嫌われたのがITT(5段階評価で4.6−4.8, 点数が高いほど嫌な検査)
平均年齢は約50歳 (J Clin Endocrinol Metab 87: 2067–2079, 2002)
IGF−1については後述. SDSは標準偏差をスコア化したもの.
ちなみに患者の好みで最も嫌われたのがITT(5段階評価で4.6−4.8, 点数が高いほど嫌な検査)
GHRH-アルギニン負荷試験の注意点
・年齢と体格によりカットオフは変化する可能性がある
15−25歳の, 小児期に発症した視床下部-下垂体不全患者 152例と201例の健常人コントロール患者においてGHRH-アルギニン負荷試験を施行.
GH欠乏症は2つ以上の誘発試験で反応低下していることで定義.
GHRH-アルギニン試験では GH<19.0µg/dLで感度100%[89.9−100], 特異度 97%[93.6−98.9]でGH欠乏症を示唆 (European Journal of Endocrinology 157 701–708, 2007 )
また、後ろ向きstudyにおいて, 年齢, 体格別のカットオフ, 感度/特異度を評価(J Clin Endocrinol Metab 94: 4414–4422, 2009)
・視床下部不全の場合、GHRH-アルギニン負荷試験では評価が困難な可能性がある
脳腫瘍, 血液腫瘍で頭部に放射線治療を受けた患者群と健常人コントロールにおいてITT, GHRH−アルギニン負荷試験を施行 (J Clin Endocrinol Metab 88: 95–102, 2003)
ITTではGH分泌は抑制されるが, GHRH-アルギニン負荷では抑制されない可能性が高い.
特に放射線療法後10年以内では、GHRH-アルギニン負荷試験による感度は低い
視床下部不全から下垂体不全へ移行するのに10年以上かかる, と理解するのが良いか.
インスリン負荷試験(ITT)では年齢や放射線療法後の経過期間を考慮せずに判断は可能な可能性が高い.
前述の平均年齢が50歳前後の患者群ではITTのカットオフは5.1µg/Lで感度/特異度は96%/92%.(J Clin Endocrinol Metab 87: 2067–2079, 2002)
母集団の平均年齢18歳の患者群におけるITTのカットオフと感度, 特異度は以下のとおり
(J Clin Endocrinol Metab 94: 4195– 4204, 2009)
・年齢と体格によりカットオフは変化する可能性がある
15−25歳の, 小児期に発症した視床下部-下垂体不全患者 152例と201例の健常人コントロール患者においてGHRH-アルギニン負荷試験を施行.
GH欠乏症は2つ以上の誘発試験で反応低下していることで定義.
GHRH-アルギニン試験では GH<19.0µg/dLで感度100%[89.9−100], 特異度 97%[93.6−98.9]でGH欠乏症を示唆 (European Journal of Endocrinology 157 701–708, 2007 )
また、後ろ向きstudyにおいて, 年齢, 体格別のカットオフ, 感度/特異度を評価(J Clin Endocrinol Metab 94: 4414–4422, 2009)
母集団
|
カットオフ
|
感度
|
特異度
|
15−25歳
|
19.1µg/L
|
83.1%[71.7-91.2]
|
90.3%[83.7-94.9]
|
26−65歳
|
14.4µg/L
|
88.1%[83.4-91.8]
|
90.3%[84.4-94.4]
|
>65歳
|
9.7µg/L
|
91.8%[80.4-97.7]
|
86.5%[78.4-92.4]
|
非肥満
|
25.0µg/L
|
91.6%[86.1-95.4]
|
92.4%[87.1-96.0]
|
Overweight
|
14.4µg/L
|
89.9%[83.7-94.4]
|
95.7%[90.3-98.6]
|
肥満
|
6.2µg/L
|
90.0%[81.2-95.6]
|
94.4%[88.3-97.9]
|
・視床下部不全の場合、GHRH-アルギニン負荷試験では評価が困難な可能性がある
脳腫瘍, 血液腫瘍で頭部に放射線治療を受けた患者群と健常人コントロールにおいてITT, GHRH−アルギニン負荷試験を施行 (J Clin Endocrinol Metab 88: 95–102, 2003)
ITTではGH分泌は抑制されるが, GHRH-アルギニン負荷では抑制されない可能性が高い.
特に放射線療法後10年以内では、GHRH-アルギニン負荷試験による感度は低い
視床下部不全から下垂体不全へ移行するのに10年以上かかる, と理解するのが良いか.
インスリン負荷試験(ITT)では年齢や放射線療法後の経過期間を考慮せずに判断は可能な可能性が高い.
前述の平均年齢が50歳前後の患者群ではITTのカットオフは5.1µg/Lで感度/特異度は96%/92%.(J Clin Endocrinol Metab 87: 2067–2079, 2002)
母集団の平均年齢18歳の患者群におけるITTのカットオフと感度, 特異度は以下のとおり
(J Clin Endocrinol Metab 94: 4195– 4204, 2009)
GH欠乏症の26例, 平均年齢20.8歳±2.3, 17−25歳の患者群でのITTカットオフ
(European Journal of Endocrinology 152 589–596 , 2005)
ITT試験はGHRH-アルギニン負荷試験と異なり年齢でカットオフに余り差はない.
大体 5−6µg/dLをカットオフとする.
血中IGF−1値の評価
・IGF−1はGHにより肝臓より分泌されるホルモン.
・GHは拍動性の分泌であるが, 末梢IGF−1値は一定した値をとり、GH欠乏の評価には有用と言える.
・IGF−1値のGH欠乏症に対する感度は不十分であるため, 正常範囲でも除外は困難.
ただし, 特異度は高く, 低値であればGH欠乏症の診断は可能.
コントロール不良の糖尿病や肝障害, エストロゲン治療がある場合は特異性も低下するため, 注意が必要.
IGF−1値は健常人でも加齢に伴い低下するため数値で評価よりも標準偏差で評価する.
標準偏差で評価する場合はSD scoreで示す.
健常人におけるIGF−1値(健常人448例での解析)(J Clin Endocrinol Metab 84: 2013–2019, 1999)
−2SD値の覚えかたは、[180−1.4x年齢(y)]
IGF-1値で評価する際の注意点
・IGF−1値が正常でもGH欠乏症は除外できない. 特に高齢者でのGH欠乏症では感度は低い
GH欠乏患者におけるIGF−1値の分布
実線と点線は健常人の値と±2SD値.
<40歳ではGH欠乏患者のほぼ全例がIGF−1 SDS < −2となるものの, >40歳ではIGF−1 SDS >-2となる例も増加する。(J Clin Endocrinol Metab 84: 2013–2019, 1999)
同様に, 年齢とIGF−1値を評価したStudy(Horm Res 2004;62(suppl 1):26–33)
高齢者ほどIGF−1 SDS >-2が多い. konoStudyでは<40歳でもIGF−1 SDS >-2となる例が多い.
GH欠乏症の治療
GH補充療法により症状の改善, 身体機能の改善, BMDの改善が見込める
GHは少量より開始し, 血中IGF−1が正常値となるように調節する.
1−2ヶ月毎にIGF−1を評価し調節
維持量固定後は半年毎に評価
GH補充療法にて期待できる効果 (Endocrine Journal 2011, 58 (5), 325-333)
・IGF−1はGHにより肝臓より分泌されるホルモン.
・GHは拍動性の分泌であるが, 末梢IGF−1値は一定した値をとり、GH欠乏の評価には有用と言える.
・IGF−1値のGH欠乏症に対する感度は不十分であるため, 正常範囲でも除外は困難.
ただし, 特異度は高く, 低値であればGH欠乏症の診断は可能.
コントロール不良の糖尿病や肝障害, エストロゲン治療がある場合は特異性も低下するため, 注意が必要.
IGF−1値は健常人でも加齢に伴い低下するため数値で評価よりも標準偏差で評価する.
標準偏差で評価する場合はSD scoreで示す.
健常人におけるIGF−1値(健常人448例での解析)(J Clin Endocrinol Metab 84: 2013–2019, 1999)
|
年齢
|
−2SD
|
中央値
|
+2SD
|
|
20−29歳
|
147
|
256
|
444
|
|
30−39歳
|
125
|
218
|
379
|
|
40−49歳
|
107
|
186
|
323
|
|
50−59歳
|
91
|
158
|
275
|
|
60−69歳
|
78
|
135
|
235
|
|
70−79歳
|
66
|
115
|
200
|
|
80−89歳
|
56
|
98
|
171
|
|
90−96歳
|
48
|
84
|
145
|
IGF-1値で評価する際の注意点
・IGF−1値が正常でもGH欠乏症は除外できない. 特に高齢者でのGH欠乏症では感度は低い
GH欠乏患者におけるIGF−1値の分布
実線と点線は健常人の値と±2SD値.
<40歳ではGH欠乏患者のほぼ全例がIGF−1 SDS < −2となるものの, >40歳ではIGF−1 SDS >-2となる例も増加する。(J Clin Endocrinol Metab 84: 2013–2019, 1999)
同様に, 年齢とIGF−1値を評価したStudy(Horm Res 2004;62(suppl 1):26–33)
高齢者ほどIGF−1 SDS >-2が多い. konoStudyでは<40歳でもIGF−1 SDS >-2となる例が多い.
GH欠乏症の治療
GH補充療法により症状の改善, 身体機能の改善, BMDの改善が見込める
GHは少量より開始し, 血中IGF−1が正常値となるように調節する.
1−2ヶ月毎にIGF−1を評価し調節
維持量固定後は半年毎に評価
GH補充療法にて期待できる効果 (Endocrine Journal 2011, 58 (5), 325-333)
GH必要量は性別, エストロゲン治療の有無で異なる
・エストロゲンはGH作用を阻害する
従って, 女性やエストロゲン治療を行っている患者ではGHの必要量が増加する.
・高齢者ではGH分泌は低下するため, GH補充療法に対する副作用の閾値も低下していると考えられる
・30−60歳では200−300µg/日程度より開始するのが良い
・>60歳では100−200µg/日,
・<30歳では400−500µg/日より開始.
・1−2ヶ月毎にIGF−1をフォローしながら, 100−200µg/日増量.
目標は症状の改善, 副作用の程度, IGF−1正常化を指標として調節する.
(J Clin Endocrinol Metab, June 2011, 96(6):1587–1609)
GH補充療法による副作用 (J Clin Endocrinol Metab, June 2011, 96(6):1587–1609)
・活動性の悪性腫瘍ではGH使用を控える.
GHは腫瘍の増殖を誘発するリスクとなりえる.
・糖尿病患者ではGHの開始とともに血糖降下薬の調節が必要
GH補充療法は耐糖能障害を増悪させるため, 投薬を再調節する
・GH治療時には甲状腺, 副腎機能もモニタリングする.
GH補充療法の副作用
・エストロゲンはGH作用を阻害する
従って, 女性やエストロゲン治療を行っている患者ではGHの必要量が増加する.
・高齢者ではGH分泌は低下するため, GH補充療法に対する副作用の閾値も低下していると考えられる
・30−60歳では200−300µg/日程度より開始するのが良い
・>60歳では100−200µg/日,
・<30歳では400−500µg/日より開始.
・1−2ヶ月毎にIGF−1をフォローしながら, 100−200µg/日増量.
目標は症状の改善, 副作用の程度, IGF−1正常化を指標として調節する.
(J Clin Endocrinol Metab, June 2011, 96(6):1587–1609)
GH補充療法による副作用 (J Clin Endocrinol Metab, June 2011, 96(6):1587–1609)
・活動性の悪性腫瘍ではGH使用を控える.
GHは腫瘍の増殖を誘発するリスクとなりえる.
・糖尿病患者ではGHの開始とともに血糖降下薬の調節が必要
GH補充療法は耐糖能障害を増悪させるため, 投薬を再調節する
・GH治療時には甲状腺, 副腎機能もモニタリングする.
GH補充療法の副作用
(Endocrine Journal 2011, 58 (5), 325-333)